Manipulasi hormon dan transgenesis merupakan
penerapan teknologi genetika dalam bidang akuakultur. Pada umumnya secara genetis jenis kelamin ikan sudah ditetapkan saat pembuahan. Namun gonad ikan yang baru menetas belum terdifferensiasi menjadi jantan atau betina sehingga proses differensiasi seks memungkinkan untuk dimanipulasi menggunakan kejutan suhu, penggunaan hormon, maupun faktor lingkungan yang lain. Tujuan manipulasi tersebut adalah untuk membudidayakan ikan berkelamin tunggal (monosex) agar pertumbuhan lebih cepat, mengontrol reproduksi dan mendapatkan penampilan yang lebih baik, serta menghindari kerusakan biodiversitas akibat ikan yang telah dimodifikasi (Zairin, 2003). Selain menggunakan teknik rekayasa kromosom menggunakan kejutan suhu seperti yang telah dibahas sebelumnya, penggunaan hormon secara langsung juga dapat digunakan untuk memanipulasi kelamin pada ikan. Hormon steroid dapat digunakan untuk memanipulasi proses diferensiasi gonad, gametogenesis, ciri-ciri kelamin sekunder, ovulasi dan spermiasi.
Teknik alih kelamin yang diterapkan di Indonesia terdiri dari jantanisasi (menghasilkan jantan) dan feminisasi (menghasilkan betina). Maskulinisasi dilakukan dengan pemberian hormon androgen 17α-methyltestosterone dan feminisasi dilakukan dengan pemberian hormon estrogen seperti 17β-estradiol.
Beberapa teknik pengalihan kelamin dapat dilakukan melalui: a. Pemberian pakan (oral), baik pencampuran pakan alami/buatan dengan hormon; b. Perendaman hormon (pada fase embrio, larva, dan induk), sehingga didapatkan keturunan ikan berkelamin tunggal.
Sementara itu, transgenik terdiri dari kata trans yang berarti pindah dan gen yang berarti pembawa sifat. Jadi, transgenik adalah memindahkan gen dari satu makhluk hidup ke makhluk hidup lainnya. Prinsip dasar teknologi rekayasa ini ialah memanipulasi atau melakukan perubahan susunan asam nukleat dari DNA (gen) atau menyelipkan gen baru ke dalam struktur DNA organisme penerima. Gen yang diselipkan serta organisme penerimanaya dapat berasal dari organisme apa saja. Misalnya gen fluorescent pada bakteri maupun ubur-ubur yang diselipkan pada kromosom ikan zebra (Danio rerio).
Makhluk hidup transgenik sering disebut sebagai GMOs (Genetically Modified Organisms) yang merupakan hasil rekayasa genetika. Transgenik terdiri dari kata trans yang berarti pindah dan gen yang berarti pembawa sifat. Teknik GMOs ini mengubah faktor keturunan untuk mendapatkan sifat baru. Teknik ini dikenal dengan rekayasa genetika atau teknologi plasmid. Pengubahan gen dilakukan dengan jalan menyisipkan gen lain ke dalam plasmid sehingga menghasilkan individu yang memiliki sifat tertentu sesuai dengan keinginan.
Gambar 1. Prinsip transgenik pada ikan
Teknologi yang dikenal sebagai teknologi DNA rekombinan ini melibatkan upaya perbanyakan gen tertentu dalam suatu sel yang bukan sel alaminya. Teknologi ini bertujuan untuk pembentukan kombinasi materi genetik yang baru dengan cara penyisipan molekul DNA ke dalam suatu vektor sehingga memungkinkannya untuk terintegrasi dan mengalami perbanyakan dalam suatu sel organisme lain. Karakteristik genetik tertentu yang dimiliki oleh seekor ikan biasanya menyatu dengan sejumlah sifat bawaan yang mempengaruhi pertumbuhan, seperti: kemampuan ikan beradaptasi terhadap lingkungan, peningkatan laju pertumbuhan, efisiensi konversi pakan ikan, perbaikan nutrisi, toleransi lingkungan, dan ketahanan terhadap penyakit.
Teknologi transgenik dapat diaplikasikan untuk mendapatkan ikan yang berukuran lebih besar dengan pertumbuhan lebih cepat yang tahan terhadap penyakit dan perubahan lingkungan. Teknologi ini juga bisa diaplikasikan untuk menghasilkan ikan hias berwarna-warni (pemberian gen fluorescent) yang dapat diturunkan pada generasi selanjutnya.
Pembentukan ikan transgenik melalui transfernDNA construct dapat dilakukan dengan beberapa metode, diantaranya:
a. Mikroinjeksi
Metode ini paling banyak digunakan karena memiliki keberhasilan yang lebih tinggi dibandingkan dengan metode lainnya. Mikroinjeksi DNA dilakukan dengan menyuntikkan DNA secara manual dari satu organisme ke telur. Waktu yang terbaik untuk proses injeksi adalah sesaat setelah fertiisasi saat ovary masih diploid (2N). Hasil penelitian menggunakan prosedur ini menunjukkan pertumbuhan keturunan yang mencapai sekitar 4-6 kali lipat pada ikan salmon; dengan FCR (food conversion ratio) atau perbandingan antara pakan yang diberikan dengan daging yang dibentuk pada ikan transgenik mencapai 0.76 sedangkan pada ikan nontransgenik 1.02. Hal ini menunjukkan bahwa ikan transgenik mampu menghasilkan satu kilogram daging dengan kebutuhan pakan sebanyak 0.76 kg sedangkan ikan biasa memerlukan 1.02 kg. Hal ini menunjukkan ikan transgenik memiliki efisiensi pakan lebih tinggi daripada ikan non transgenik (Alimuddin, 2004).
b. Infeksi pada Virus (Retroviral infection)
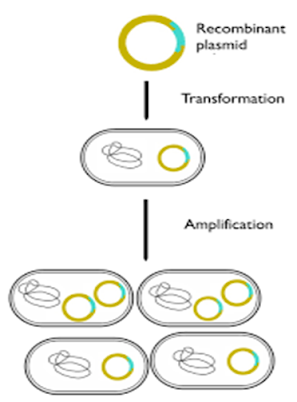
Introduksi gen melalui virus sebagai mediator (vector). Pada metode ini, virus ditumpangi gen yang diinginkan dan diintroduksikan kedalam embrio ikan melalui virus sebagai vector pembawa. Virus memiliki ukuran yang sangat kecil dan mampu menembus inti sel. Satu sel diinfeksi dengan satu retrovirus akan menghasilkan DNA virus yang selanjutnya ditranskripsikan (penyalinan dan perbanyakan DNA/amplification) sehingga menjadi bagian genom induk. Contoh spesies yang menggunakan metode ini adalah ikan zebra (
Brachydanio rerio).
Gambar 2. Prosedur perbanyakan sel pada inang
c. Sperma sebagai pembawa gen
Jika pada pembahasan sebelumnya vektor yang digunakan adalah virus, teknik ini menggunakan spermatozoa sebagai sarana seluler (vektor) untuk mentransfer DNA asing kedalam oosit sehingga terlibat langsung dalam proses fertilisasi. Matriks DNA diikat oleh komponen protein spesifik pada area post-acrosomal dan akan bergabung dengan genom induk setelah terjadi fertilisasi. Pengikatan gen oleh sperma optimal saat sperma dalam keadaan motil dan konsentrasi DNA cukup tinggi.
Gambar 3. Transfer gene dimediasi sperma
(Sumber: Louis-Marie, 2002)
d. Elektroporasi (Electroporation)
Pada metode ini, gamet atau embrio ditempatkan pada suatu cuvet dimana membran selnya memungkinkan menerima molekul DNA melalui paparan listrik sesaat. Ketika aliran listrik dimatikan dan membran sel kembali seperti semula, fragment-fragment DNA tersebut akan menetap dalam gamet atau embrio. Metode ini mudah dan cepat, sehingga memungkinkan untuk dilakukan pada ratusan oosit/telur ikan yang telah difertilisasi dalam satu kejutan listrik.
Keberhasilan penerapan teknologi transgenik bergantung pada transfer gen yang diekspresikan dan diwariskan dengan cara yang dapat diprediksi dan cenderung stabil. Ikan transgenik memberikan keuntungan pada pertumbuhan ikan. Hasil analisis berat badan ikan non transgenik dan transgenik pada ikan nila menunjukkan bahwa keturunan F2 (keturunan F2 adalah perkawinan antara jantan F1 dengan betina alam), ikan transgenik menghasilkan berat berkisar antara 60 – 90 gram/individu pada umur 5, 6, dan 7 bulan, sedang pada ikan non transgenik menghasikan berat berkisar antara 20 – 30 gram/individu, dari hasil tersebut menunjukkan bahwa pada keturunan ke 2 (F2) sifat tumbuhnya masih dapat diturunkan, dan pertumbuhannnya sekitar 3 kali lipat dibandingkan dengan ikan kontrol (Sin et al, 2002). Penambahan gen dari ikan salmon dengan cara melipatgandakan jumlah gen yang bekerja dalam sintesa asam lemak HUFA meningkatkan kadar EPA dan DHA dalam tubuh ikan sebesar 1.4 dan 2.1 kali lipat daripada ikan biasa (Alimuddin et al, 2005). Selain itu, teknologi transgenik dapat menyediakan produksi rata-rata bagi pembudidaya untuk mendapatkan ikan yang berkualitas tinggi, rasa dan tekstur daging baik, komposisi mutu lengkap, warna yang menarik dan tahan terhadap penyakit dan perubahan lingkungan.
Kesimpulan
Meskipun aplikasi rekayasa genetik pada ikan budidaya telah banyak diterapkan di Indonesia, namun manfaat yang diperoleh belum optimal karena belum tersedianya program besar yang terarah dan berkesinambungan untuk menghasilkan suatu produk yang memberikan manfaat terhadap budidaya secara langsung. Selanjutnya, diharapkan teknologi yang telah tersedia dapat diaplikasikan untuk meningkatkan produktivitas pembudidaya di Indonesia. Penerapan teknologi yang akan digunakan sangat tergantung pada status terkini kualitas genetik komoditas yang akan diperbaiki dan permasalahan teknis yang dihadapi.
Referensi:
Alimuddin, Yoshizaki, G., Kiron, V., Satoh, S., & Takeuchi, T. 2004. Enhancement of EPA and DHA biosynthesis by over-expression of masu salmon D6-desaturaselike gene in zebrafish. Transgenic Res.
Alimuddin, -------------------------------------------------------------. 2005. Modification of fatty acids composition in zebrafish by expression of masu salmon D6-desaturase-like gene.
Breadmore, J.A., dan J. S. Porter. 2003. Genetically Modified Organisms and Aquaculture. FAO Fisheries Circular No. 989. Rome. 38p.
Kristanto, A.H., dan E. Kusrini. 2007. Peranan Faktor Lingkungan dalam Pemuliaan Ikan. Media Akuakultur. 2(1): 183-188
Kurniasih, T., dan R. Gustiano. Hibridisasi sebagai Alternatif untuk Penyediaan Ikan Unggul. Media Akuakultur. 2(1): 173-176.
Rosmaidar., C.N. Thasmi., A. Afrida., M. Akmal., Herrialfian., et al. 2016. Pengaruh Lama Perendaman Larva dalam Hormon Metil Testosteron Alami Terhadap Penjantanan Ikan Lele Dumbo (Clarias gariepinus). Jurnal Medika Veterinaria. 10(2): 125-127. Zairin, M.Jr. 2003. Endokrinologi dan Peranannya bagi Masa Depan Perikanan Indonesia. Orasi Ilmiah Fisiologi Reproduksi dan Endokrinologi Hewan Air. Institut Pertanian Bogor.